 |
|
d'après Bayard, Encyclopédie entomologique Ed. Lechevallier |
Depuis le début du 20ème siècle, les entomologistes ont à leur disposition des moyens de détermination des espèces tout à fait remarquables. Parmi ceux-ci on retiendra ceux qui se basent sur l'étude des structures génitales, plus ou moins sclérifiées, des mâles et des femelles. Ils ont été développés surtout à partir des années 1940.
Principes
Tous les individus d'une même espèce, tant
mâles que femelles, présentent des structures génitales,
ou genitalia, identiques pour chacun des sexes. Ces structures, typiques,
sont différentes pour chaque espèce. Elles sont proches pour
toutes les espèces d'un même genre, et très différentes
pour les espèces appartenant à un autre genre, une sous-famille
ou une autre famille. Les analyses de ces structures sont utilisées
surtout chez les Lépidoptères, les Coléoptères,
Les Orthoptères et les Diptères (Moustiques). Pour illustrer
ce propos nous nous en tiendrons uniquement aux genitalia des Lépidoptères.
Ces structures sont référencées
par rapport aux Lépidoptères ditrysiens femelles, c'est à
dire ayant 2 orifices génitaux distincts, l'un pour l'accouplement
et l'autre pour la ponte. Pour les papillons du jour, ou Rhopalocères,
il peut y avoir de petites différences avec les Hétérocères,
ou papillons de nuit, au niveau de certaines formations comme l'uncus
(avec
l'existence d'un super-uncus plus ou moins développé).
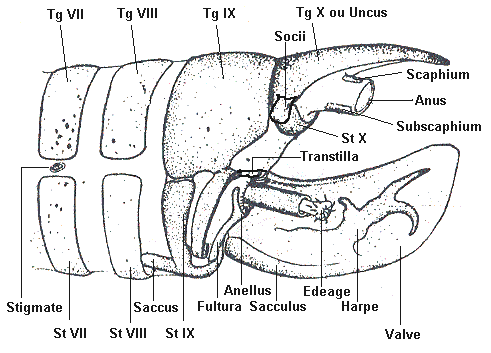
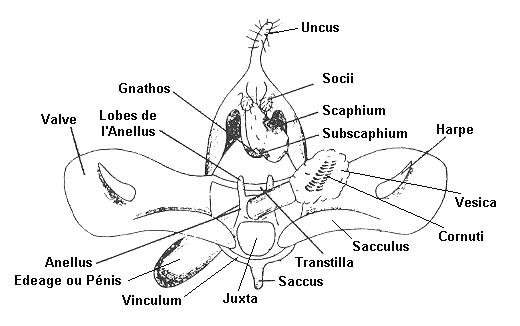
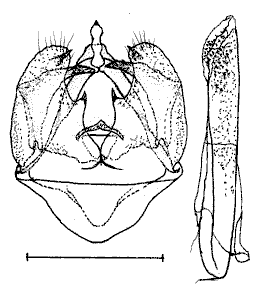
Les genitalia d'un mâle
de Lépidoptère
Les pièces génitales, appelées aussi
armatures génitales, sont situées à l'extrémité
de l'abdomen, sur les derniers segments. Elles sont plus ou moins visibles
selon les espèces. Généralement une paire de formations,
symétriques, émerge. Ce sont les valves. Lors de l'accouplement,
la femelle est fermement maintenue en place par trois processus externes
du mâle : un crochet dorsal, l'uncus, et deux plaques latérales,
les
valves. Ces valves maintiennent latéralement l'extrémité
de l'abdomen de la femelle, tandis que l'uncus s'insère dorsalement
dans la membrane intersegmentaire du dernier anneau de la femelle.
 |
|
d'après Bayard, Encyclopédie entomologique Ed. Lechevallier |
Sur ces structures sont insérés des muscles
qui servent à l'accouplement. Le mâle, alors, introduit son
pénis, ou
edeage, dans l'orifice de copulation de la femelle,
ou ostium bursae, et injecte ses spermatozoïdes par le truchement
d'un spermatophore. Ce dernier, qui abrite les spermatozoïdes,
est un conduit creux et gélatineux. Il glisse le long d'un canal
appelé le ductus bursae, jusqu'à une sorte de sac
appelé bourse copulatrice. De cette bourse une très
fin canal, nommé ductus seminalis, amène la semence
jusqu'aux ovaires. L'accouplement est long et peut durer plusieurs
heures.
 |
|
|
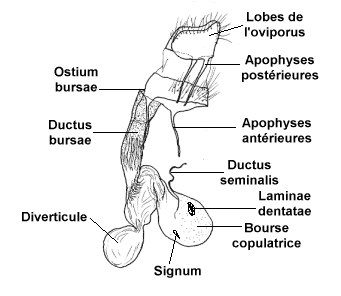
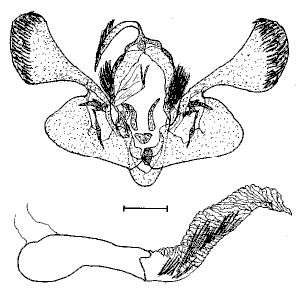
Les genitalia d'une femelle de
Lépidoptère
La structure génitale de la femelle comprend des
pièces externes plus ou moins sclérifiées que l'on
appelle les plaques anté- et -postvaginales. Elles entourent
l'orifice de copulation, ou ostium bursae. De cet orifice génital,
part un conduit interne plus ou moins long et plus ou moins complexe, le
ductus bursae, qui aboutit à une sorte de grand sac appelé
bourse copulatrice. Sa forme est généralement oblongue,
mais elle peut prendre des formes multiples, avec des diverticules plus
ou moins longs et plus ou moins sclérifiés. Les parois de
la bourse peuvent être minces ou épaisses, plissées
ou lisses. Elles portent parfois des épines (signum) ou des
zones sclérifiées garnies de nombreuses petites épines,
plus ou moins fortes, appelées
laminae dentatae.
De la bourse copulatrice ou du ductus bursae est issu
un très fin conduit, le ductus seminalis, qui aboutit aux
ovaires. Il permet aux spermatozoïdes de migrer pour féconder
les ovules, à la demande de la femelle. Lors de l'étude des
genitalia de la femelle, on observe souvent des vestiges de plusieurs spermatophores.
C'est le résultat de plusieurs accouplements de la femelle durant
sa vie éphémère qui dure environ 3 semaines.
La ponte se fait par l'orifice de ponte qui est encadré
par deux processus appelés lobes de l'oviporus. Ces lobes
membraneux sont couverts de poils sensitifs très nombreux qui aident
la femelle à positionner ses oeufs sur la feuille de la plante hôte.
 |
|
d'après Guillermet, 1996 |
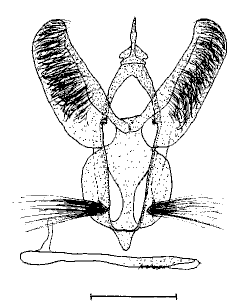
Des exemples
Voici quelques exemples montrant les différences
de formes dans les valves, l'edeage, l'uncus, la bourse copulatrice, le
ductus bursae et les processus internes.
 |
 |
 |
|
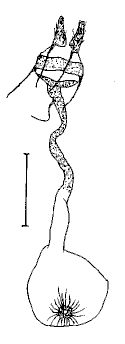
(Guenée, 1857) Uraniidae, Epipleminae Genitalia du mâle |
Guenée, 1854 Noctuidae Quadrifide, Herminiinae Genitalia du mâle |
Guillermet, 1996 Noctuidae Trifide, Hadeninae Genitalia du mâle |
 |
 |
 |
|
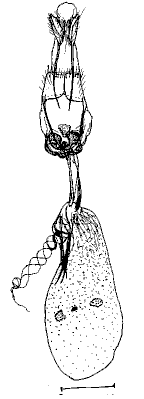
(Guenée, 1857) Uraniidae, Epipleminae Genitalia de la femelle |
Guenée, 1854 Noctuidae, Herminiinae Genitalia de la femelle |
Guillermet, 1996 Noctuidae Trifide, Hadeninae Genitalia de la femelle |
Les outils nécessaires
- Tout d'abord, une loupe binoculaire et son éclairage.
Elle devra comporter divers grossissements, car les armures génitales
varient en importance selon la taille de l'animal (1/4 de mm à 1
cm).
- Deux paires de très fines pincettes, pointues,
afin d'attraper les tissus très fins. Prévoir une pierre
à aiguiser afin de les affûter.
- Deux petites spatules en bois souple (faites avec des
baguettes de "mikado", par exemple)
- Une multitude de petits flacons de 15 ml, portant un
bouchon qui se visse.
- De petits cristallisoirs en verre, des verres de montre,
de petits bécher et des pipettes en verre.
- Des étiquettes à coller sur les flacons.
- Un carnet de poche pour numéroter chaque flacon.
- Des étiquettes pour numéroter chaque
insecte.
- Une chaufferette électrique pour chauffer la
potasse ou la soude.
- Des lames et lamelles pour microscopie.
- De petites pissettes en plastique, et de petites seringues
de 1 ml.
- Un torchon en lin et des "essuie tout".
- Des coffrets de rangement à rainures verticales
pour les préparations microscopiques sèches et d'autres pour
les préparations en position horizontale (pour le séchage).
- Une source de lumière, genre projecteur de diapositives,
projetant les préparations microscopiques sur un plan de travail,
pour les dessiner.
Les produits chimiques
- Du noir chlorazol pour colorer les genitalia. Ce produit
est très cher et ne supporte pas la lumière. Il peut être
remplacé par du mercurochrome (attention, pas d'éosine).
Cependant pour la conservation des genitalia des types, il est préférable
d'utiliser le noir chlorazol.
- Du baume du Canada (sorte de résine qui servira
à monter les préparations entre lame et lamelle).
- Du toluène et des cristaux d'acide phénique
pour déshydrater les préparations. Attention, ces produits
sont très toxiques. Une bonne ventilation de la pièce où
l'on procède est nécessaire. Les vapeurs de toluène
sont très inflammables. Voilà une bonne occasion pour arrêter
de fumer !!!
- De la postasse, ou de la soude caustique, en solutions
saturées. Ces produits sont toxiques et brûlent la peau.
- Des gants de chirurgien éviteront bien des problèmes
lors de la manipulation de ces produits chimiques.
- De l'eau, de l'alcool à 70°, 90° et
absolu.
- Un flacon d'encre de Chine et le nécessaire
pour s'en servir.
Les techniques employées
1- Le "potassage"
L'abdomen, détaché du corps du papillon,
est mis à macérer dans un bain de potasse ou de soude caustique
saturée, dans un petit flacon de 15 ml. Ces deux produits chimiques
digèrent les graisses et permettent de repérer facilement
les structures génitales. La potasse, ou la soude, est préalablement
colorée avec du mercurochrome. Cette première coloration
de l'abdomen, aidera à repérer les différentes pièces
des armures génitales, parfois difficiles à distinguer des
amas graisseux résiduels. A froid, le potassage demande de 3 à
7 jours, selon la grosseur de l'abdomen.
A chaud, quelques heures suffiront, en plaçant
le flacon, bouché, sur une petite plaque électrique chauffante,
dont la température ne devra pas excéder 70 à 80°.
Eviter de faire bouillir la préparation, et attention aux projections
dans les yeux ou sur la peau.
2- Le nettoyage de l'abdomen et l'extraction des pièces
génitales
L'opération est délicate.
- Elle consiste, tout d'abord à
éliminer les poils et les écailles qui recouvrent l'abdomen.
On se servira des baguettes de "mikado" dont une extrémité
est taillée en forme de spatule. En tapotant l'abdomen avec ces
baguettes, on parvient assez rapidement à découvrir la cuticule
de l'abdomen. Elle est à conserver, car des caractères de
systématique permettent de faciliter les déterminations.
- En un deuxième temps, on
repère la membrane latérale qui réunit tergites et
sternites. Avec les pincettes métalliques, on déchire cette
membrane, afin d'étaler la cuticule de l'abdomen et d'avoir accès
aux pièces génitales. Cette opération est indispensable
pour dégager les armatures génitales de la femelle. Celles
du mâle peuvent être dégagées en saisissant l'uncus
et en le tirant vers l'extérieur. Les valves sont alors complètement
dégagées.
- En un troisième temps, on
enlèvera les graisses restantes, ainsi que les restes des divers
organes de la digestion. La pré-coloration des genitalia permet
de bien séparer les pièces génitales et d'éviter
de les sectionner par inadvertance.
Cette opération se fera sous la loupe binoculaire,
dans un petit cristallisoir, avec très peu d'eau (quelques gouttes
suffisent).
3- Préparation et 2ème coloration des
genitalia
Coloration au mercurochrome
On lavera plusieurs fois, à la pissette, les organes
génitaux et la cuticule abdominale, dans de l'eau pure, avant de
les laisser reposer dans un petit flacon de 15 ml, avec 1 ou 2 ml d'eau
colorée au mercurochrome, pendant 24 heures. La coloration doit
être assez vive. Le rapport 1ml de mercurochrome et 1 ml d'eau donne
de bons résultats.
Coloration au noir chlorazol
Après le lavage en eau pure, les éléments
à colorer sont passés pendant quelques instants dans les
alcools (70° et 90°), puis on les immerge dans une solution alcoolisée
de noir chlorazol, pendant 1 à 3 minutes selon la concentration.
Puis on lave dans une solution d'alcool à 70° additionnée
d'eau.
Attention, autant on peut éclaicir une préparation
coloriée au mercurochrome par l'ajout de quelques gouttes d'une
solution d'hypochlorite de sodium (eau de Javel), autant il est très
difficile d'éclaircir une préparation traitée au noir
chlorazol (la plonger pendant plusieurs heures dans une solution d'alcool).
4- Déshydratation des genitalia et montage entre
lame et lamelle
Déshydratation
Dans un flacon de 15 ml on dissout, à saturation,
des cristaux d'acide phénique dans du toluène. Cette opération
engendre un abaissement de la température du toluène. Les
cristaux d'acide phénique brûlent la peau. Il est indispensable
de porter des gants de chirurgien pendant la manipulation.
Les genitalia et la peau de l'abdomen sont passés
à l'alcool à 90° pendant quelques instants avant d'être
plongés dans le toluène phéniqué. La déshydratation
est effective en quelques minutes (selon la grosseur des pièces
à déshydrater).
Montage entre lame et lamelle
Pendant la déshydratation on prépare lame
et lamelle. On veillera à à ce qu'elles soient parfaitement
propres, sans graisse ni dépôts. Le torchon en lin se prête
bien à cette opération.
Après avoir placé une petite goutte de
Baume du Canada au centre de la lame (diluée par l'adjonction d'une
goutte de toluène phéniqué), on y dispose les armatures
génitales et la cuticule abdominale. L'action du Baume tend à
ramollir les pièces génitales et facilite leur disposition.
On ouvrira les valves (si cela est possible), on disposera l'edeage sous
l'armature génitale après l'avoir extrait de sa loge. C'est
une opération délicate. Dans la mesure du possible, si cela
est nécessaire, avec une petite aiguille montée sur une seringue,
on développera la vésica pour en montrer les spicules et
les épines.
Pour les genitalia de la femelle, on veillera à
extraire de la bourse copulatrice les spermatophores, en l'incisant légèrement
avec les pincettes.
La présence de bulles adhérent aux organes,
indique un manque de déshydratation. L'adjonction d'une goutte de
toluène phéniqué devrait régler le problème.
Au centre de la lamelle, on disposera une petite goutte
de Baume du Canada mélangée avec du toluène. Elle
sera retournée et appliquée sur la préparation. Il
y a un coup de main à prendre......
Le séchage peut prendre plusieurs semaines. Chaque
préparation microscopique est disposée à plat dans
une petite boîte. Je me sers des petits ensembles en plastique, portant
de nombreux tiroirs pour ranger vis, boulons et clous. C'est très
pratique et pas cher !
Le séchage peut être accéléré
en se procurant une petite étuve ou en bricolant une boîte
en bois portant des clayonnages de séchage. Une petite ampoule de
5 à 10 watts sous 220 volts disposée à l'intérieur
de la boîte assurera le chauffage. La température sera modulée
en ouvrant plus ou moins le couvercle de la boîte !
Les étiquetages
Chaque insecte dont on aura enlever l'abdomen devra porter
un numéro de genitalia et la date de l'opération. Ces renseignements
seront portés sur un carnet où chaque page portera le numéro
des genitalia. On y dessinera à main levée les détails
ou l'attitude générale de la préparation. Ce numéro
sera reporté sur le flacon de potassage, ainsi que sur la lame.
Sur cette dernière on ajoutera le nom de l'insecte, le nom du préparateur
et la date de préparation. Par précaution on ajoutera les
indications entomologiques classiques, telles que le site et la date de
capture. Toutes ces inscriptions se feront, de préférence,
à l'encre de Chine.
Dessins des structures génitales
La préparation microscopique, quel que soit son
état de séchage, est mise sous le projecteur à dessiner.
On dessinera les contours, les traits bien marqués, mais pas les
détails. Le reste se fait à la loupe binoculaire. On se fabriquera
un étalon de mesure en découpant dans une règle plate
en matière plastique transparente quelques éléments
gradués. Le millimètre est l'unité de mesure. Cette
unité de mesure devra être portée sur le dessin, par
projection.
Bibliographie
Je n'indiquerai que deux publications. Elles devraient
vous suffire pour mener à bien vos manipulations. Seule la pratique
permet de trouver des solutions aux problèmes techniques rencontrés.
- Carayon Jacques - "Emploi du noir chlorazol en anatomie
microscopique des insectes", Annales de la Société Entomologique
de France, (N. S.), 5 (1), 1969, p. 179 à 193.
- Gibeaux Christian - "Les Genitalia mâle et femelle
; Les principaux noms utilisés dans leur étude (Lepidoptera)",
Ent. gall. 1 (2), p. 110 à 115.